-
-
藥品生產企業集中QA管理系統(CQA)
利用先進的技術,將”人、機、料、法、環“五個關鍵質量要素有機結合,確保數據準確、及時、完整、可追溯的實時監管預警分析追溯系統
系 統 概 述
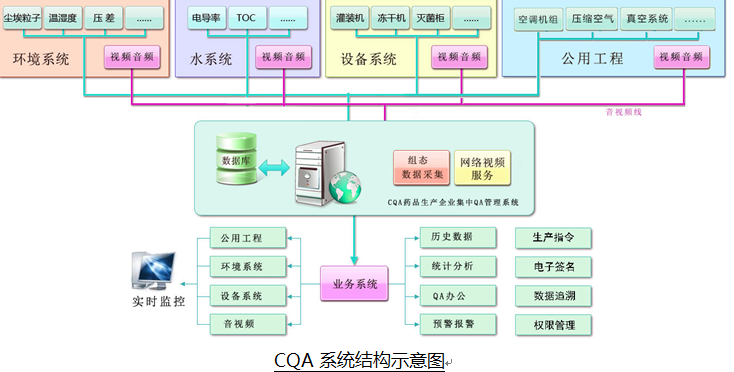
“耀智CQA藥品生產企業集中CQA質量管理系統 (以下簡稱YOZEE-CQA)”為藥品生產企業及質量保證人員提供全面、完整、高效的質量保證管理平臺,主要利用視頻監控、音頻通信、數據采集等技術實現質量保證人員對生產區域中的設備運行狀態、人員工作情況等的監控;系統將QA日常工作納入管理,實現規范、完整的電子化數據,實現質量保證人員的信息化辦公。
利用平臺提供的統計分析功能,實現各生產批次設備、環境、用水、公用等系統的數據匯總,結合質量保證人員填寫的記錄,實現質量保證環節的生產記錄功能,并提供按生產批次的導出功能。同時,系統提供偏差處理、風險評估等的報告填寫及導出功能。
利用電子簽名實現人員信息的數據身份識別,在保證合規性的同時使人員操作(如批次信息制定、產品配方制定、生產執行時,應使用雙重身份認證,實現電子簽名)具有法律效力。
提供完善的數據備份及恢復方案,利用服務器本身的雙硬盤配置RAID1結構,實現服務器實時硬盤備份,避免因硬盤壞道、損壞等產生的數據丟失或無法正常存取數據;利用異地備份等形式實現數據實時備份,避免因服務器宕機引起的數據丟失;集中CQA質量管理系統利用數據庫自身機制實現數據庫快照及增量備份,便于在數據庫崩潰時快速恢復數據到最新備份點。
借助加密手段對數據庫訪問鏈路、應用程序訪問、權限控制等增加安全措施,保證系統數據及訪問的安全、可靠、一致、準確。
 |  |
系 統 背 景
藥品生產企業質量保證人員在工作中需要全面了解生產活動中的各項數據,如設備狀態、生產環境、工藝參數等的變化;生產批次信息與各種數據的關聯關系,如生產記錄中需要的該批次工藝參數、環境數據等;在生產過程中需與生產人員進行適當交流;將偏差處理、風險評估、GMP認證管理等內容進行信息化管理,以便形成系統化管理。
2010版對數據與記錄管理的要求 第一百五十八條 良好的文件是質量保證系統的基本要素,本規范所指的文件包括質量標準,工藝規程、操作規程、記錄、報告等。…… 第一百六十五條 記錄應留有數據填寫的足夠表格。記錄應及時填寫,內容真實,字跡清晰、易讀,不易擦掉 第一百六十六條 應盡可能采用生產和檢驗設備自動打印的記錄,圖譜和曲線圖等,并表明產品或樣品的名稱、批號和記錄設備的信息。操作人應簽注姓名和日期。 第一百六十七條 記錄應報紙清潔,不得撕毀和任意涂改,記錄填寫的任何更改都應簽注姓名和日期,并使原有信息仍清晰可辨,必要時,應說明更改的理由。記錄如需重新譽寫,則原有記錄不得銷毀,而應作為重新譽寫記錄的附件保存。 | 2010版對數據與記錄管理的要求 第一百六十八條 與本規范有關的沒想活動均有記錄,所有記錄至少應保存至藥品有效期后一年,確認和驗證、穩定性考察的記錄和報告等重要文件應長期保存,以保證產品生產、質量控制和質量保證等活動可以追溯。 每批藥品應有批記錄,包括生產記錄、批包裝記錄、批檢驗記錄和藥品放行審核記錄等與本批產品有關的記錄和文件。批記錄應由質量管理部門負責管理。 第一百六十九條 如使用電子數據處理系統、照相技術或其他可靠方式記錄數據資料,應有所用系統的詳細規程;記錄的準確性應經過核對,如果使用電子數據批記錄系統,只有授權人員方可通過計算機輸入或更改數,更改和刪除情況應有記錄:應使用密碼或其它方式來限制數據系統的登陸:關鍵數據輸入后,應由他人獨立進行復核。用電子方法保存的批記錄,應采用磁帶、縮微膠卷、紙質副本或其他方法進行備份,以確保記錄的安全,且數據資料在保存期內應便于查閱。 |
2010版對數據與記錄管理的要求 第二百二十一條 質量控制實驗室的文件應當符合第八章的原則,并符合下列要求: (一) 質量控制實驗室應到至少有下列詳細文件; 1、 質量標準; 2、 取樣操作規程和記錄; 3、 檢驗操作規程和記錄(包括檢驗記錄或實驗室工作記事簿); 4、 檢驗報告或證書; 5、 必要的環境監測操作流程、記錄和報告; 6、 必要的檢驗方法驗證報告和記錄; 7、 儀器校準和設備使用、清潔、維護的操作規程及記錄; (二) 每批藥品的檢驗記錄應當包括中間產品、待包裝產品和成品的質量檢驗記錄,可追溯該批藥品所有相關質量檢驗情況。 (三) 宜采用便于趨勢分析的方法保存某些數據(如檢驗數、環境監測數據、制藥用水的微生物監測數據)。 (四) 除與批記錄相關的資料信息外,還應保存其他原始資料或記錄,以方便查閱。 | 醫藥工業發展規劃指南 應用信息技術改進質量管理。建立生產質量信息實時監控系統,實現質量數據的自動采集、管理和可追溯,保證數據的真實性和完整性。開發應用基于過程分析技術的智能化控制系統,建立質量偏差智能預警系統,最大限度約束、規范和減少員工操作,促進GMP嚴格執行,有效保證產品質量穩定。 |
系統建設目標
以數據采集、視頻監控、音頻通迅等手段為基礎,結合質量保證人員工作中的側重點,形成一套數據完整、可靠、高效的集中質量保證平臺;通過利用數據的自動采集、預警報警、統計匯總減少因人為因素造成的數據偏差;通過增加音視頻通訊手段減少質量保證人員進出潔凈區的次數,減少因人為因素造成的安全隱患;通過將生產批次與數據采集相結合,實現批次化生產工藝數據的完整性管理,并提供按生產批次數據包的導出功能。集中CQA質量管理系統的建設需要符合計算機化系統驗證要求,遵循GMP、 21 CFR PART 11等相關法規。
數據安全、準確、一致、可驗證、可追溯是項目建設的基本目標。
系 統 功 能
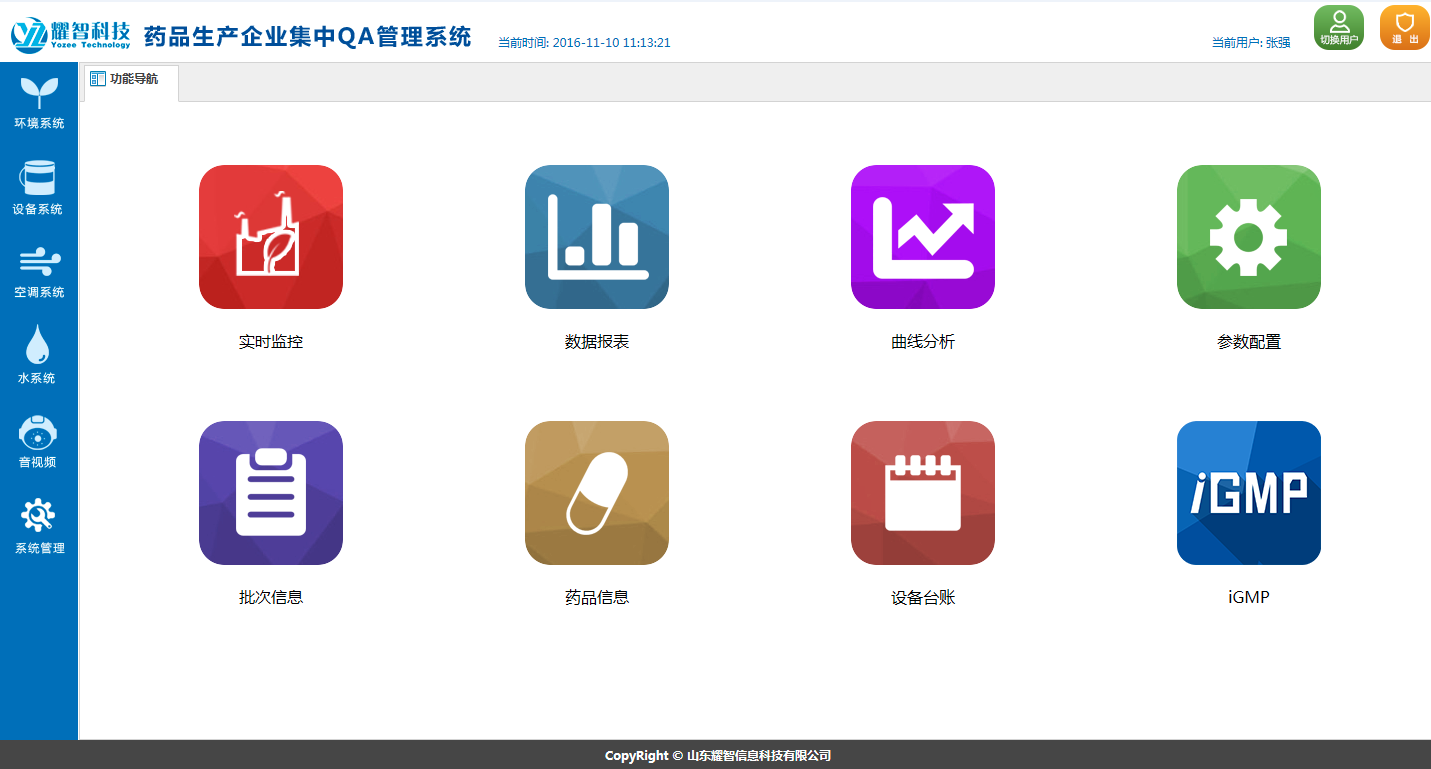 | 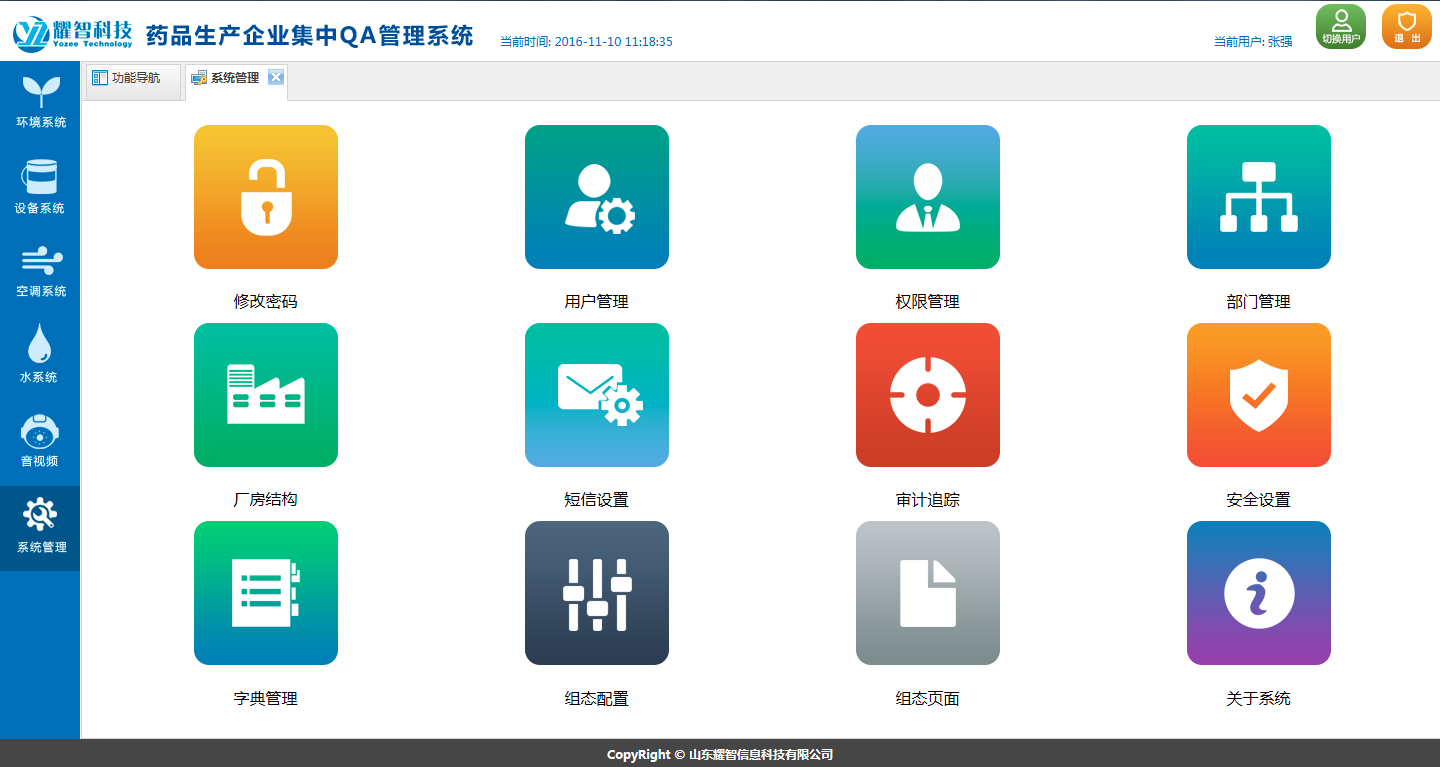 |
以上資料來自山東耀智信息科技有限公司官方網站,網址:http://m.rcoutfitters.cn
- 上一條BRS藥品生產企業電子批記錄系統
- 下一條EAM設備管理系統



