21CFR11 和 GAMP5 在潔凈室中實現數據完整性的基礎知識

美國食品和藥物管理局 (FDA) 將數據完整性定義為“數據的完整性、一致性和準確性。完整、一致和準確的數據應是可歸屬的、清晰的、同時記錄的、原始的或真實的副本,并且準確(ALCOA)。在潔凈室中,數據完整性向監管機構證明潔凈室遵循最佳實踐并生產安全產品。
雖然在每小時生成數千條數據的潔凈室中保持最高水平的數據完整性似乎令人生畏,但這是可能的。首先,必須了解有關潔凈室數據完整性的一些準則和法規,包括 21CFR11 和 GAMP。
什么是 21CFR11?
21CFR11是指FDA聯邦法規第11篇的第21部分。這是法規中關于如何處理必須提交給FDA的數據的指導的部分。該措施允許在數據處理中使用數字技術,因為它概述了如何確保對數據完整性的信心。
FDA于21年推出了11CFR1996。從那時起,為了跟上技術變化的步伐,第 11 部分進行了許多更改。這不是一份停滯不前的文件,而是自創建以來隨著行業需求而發展的法規。第11部分的最初目的是使制藥公司在生產高度管制的產品時更加靈活。組織已經能夠將大部分流程數字化,而不是追逐物理簽名和整理紙質文檔以進行 FDA 審核。
第 11 部分平衡了行業快速將產品推向市場的需求與最高級別的認證和控制要求。
為了幫助組織遵守 21CFR11 并保持其數據完整性,FDA 在 1990 年代引入了 ALCOA 的概念。他們后來繼續發布ALCOA+,現在被認為是維護包括FDA和GAMP在內的眾多組織數據完整性的標準做法。
什么ALCOA+?
ALCOA 代表 歸屬、清晰、當代、原創和準確。ALCOA+繼續包括數據也必須是完整,一致,持久和可用的。這些是保持與全球監管機構的高標準兼容的高水平數據完整性的基礎。
歸因: 必須清楚是誰記錄了日期,并附有簽名和日期。
清晰: 數據必須能夠清楚地理解,沒有無法解釋的符號。
同期: 數據應在生成后立即記錄。
起初: 數據應為原件或經認證的副本。
準確: 數據應準確反映情況或觀察結果。
完成: 記錄不應遺漏任何內容 - 包括測試和重新測試。
一致: 時間戳應按預期順序出現。總體而言,數據生成應該是相同的。
持久: 數據只能使用無效的電子系統記錄(或者,如果不可用,則使用實驗室筆記本中的受控工作表)。
可用: 在記錄的生存期內,它需要隨時可供審查和審核。
遵循這些準則,您應該能夠保持最高級別的數據完整性,并遵守監管機構(如 FDA 和 GAMP)制定的標準。

什么是GAMP5?
GAMP 代表 良好的自動化制造規范。它既是國際制藥工程學會(ISPE)的一個小組委員會,也是一套制藥潔凈室指南。GAMP5 特別提到了指南中涵蓋如何設計潔凈室環境監測系統 (EMS) 以保持數據完整性并生產安全產品的部分。
雖然GAMP5是制藥組織的技術指南,但所提供的信息對于任何使用潔凈室的人來說都是有價值的。
GAMP5 使用 V 模型來演示實施 EMS 時應采取的步驟。這是一個詳盡的過程,可幫助您在設計級別解決所有問題,而不是在以后的應用程序階段。雖然在經歷它時可能會感覺過于徹底,但當實施更加無縫且出現的問題更少時,您會感謝這個過程。
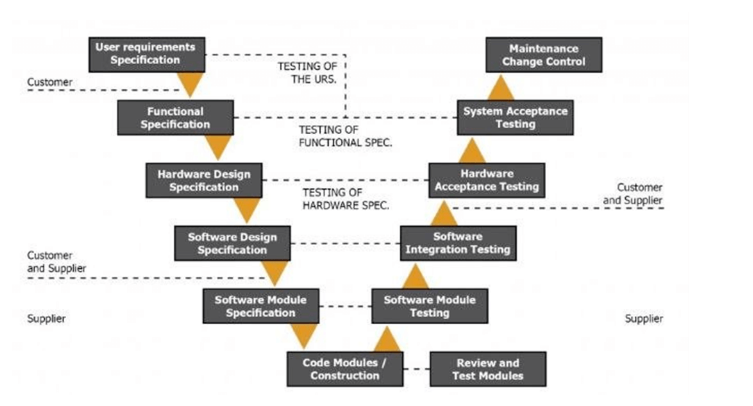
EMS 與 21CFR11 和 GAMP5 有什么關系?
21CFR11 和 GAMP5 都迭代了數據完整性的重要性。否則,您的潔凈室將無法通過審核或獲得認證。數據完整性的關鍵是使用圍繞這些準則和法規設計的 EMS,將數據完整性和質量置于創新的最前沿。
我們的環境監測系統旨在遵循 GAMP5 和 21CFR11 規定的最佳實踐,以保持數據完整性。將這些指南構建到 EMS 中,并允許進一步定制。借助我們強大的軟件集成,可以輕松提取報告并證明數據完整性。
- 上一條數據完整性FDA法規
- 下一條潔凈室監測相關的計數效率